Química Inorgânica: Uma Introdução: Defina Substâncias Pertencentes A Função Inorgânica Básica De Dois Exemplos

Defina Substâncias Pertencentes A Função Inorgânica Básica De Dois Exemplos – A química inorgânica estuda a composição, estrutura, propriedades e reações de compostos que não são baseados em cadeias de carbono. A compreensão desses compostos é fundamental para diversas áreas, desde a medicina até a indústria de materiais. Esta exploração abordará conceitos chave da química inorgânica, focando nas funções óxidos e ácidos, com exemplos e comparações para facilitar a compreensão.
Conceitos Fundamentais da Química Inorgânica
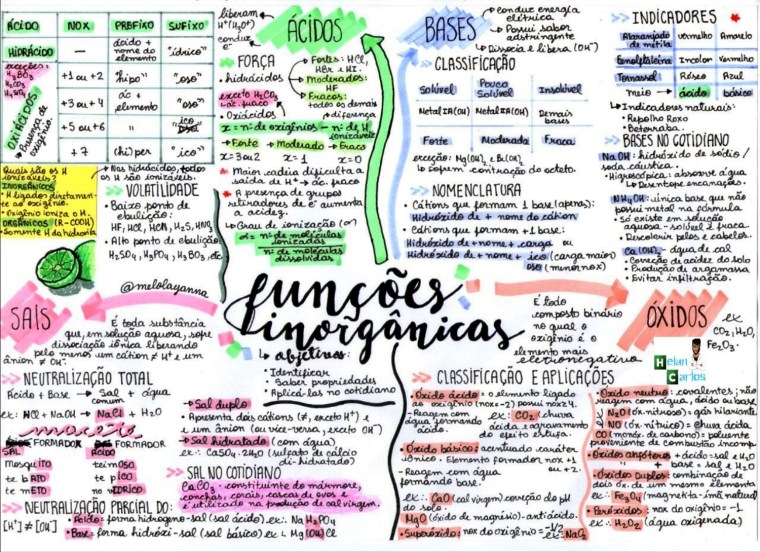
Substâncias inorgânicas são compostos químicos que, geralmente, não possuem átomos de carbono ligados a átomos de hidrogênio, formando cadeias carbônicas. Exceções existem, como o dióxido de carbono (CO2) e o carbonato de cálcio (CaCO3), que são considerados inorgânicos devido às suas características e propriedades. As principais funções inorgânicas incluem óxidos, ácidos, bases, sais e hidretos, cada uma com propriedades e reações características.
O estudo dessas substâncias é crucial para o desenvolvimento de novos materiais, medicamentos, e a compreensão de processos naturais e industriais.
Substâncias Óxidos: Propriedades e Aplicações
Óxidos são compostos binários formados por um elemento químico e o oxigênio, com fórmula geral <b>ExO y</b> , onde E representa o elemento químico e x e y são os seus respectivos índices. A nomenclatura tradicional baseia-se na valência do elemento, enquanto a nomenclatura IUPAC utiliza os prefixos numéricos (mono, di, tri, etc.) para indicar a proporção dos elementos.
A seguir, dois exemplos de óxidos com suas propriedades e aplicações:
| Nome do Óxido | Fórmula Química | Propriedades | Aplicações |
|---|---|---|---|
| Óxido de Sódio | Na2O | Sólido branco, reage vigorosamente com água formando hidróxido de sódio (NaOH), altamente básico. | Produção de vidros e cerâmicas. |
| Dióxido de Silício | SiO2 | Sólido incolor, muito duro e resistente a altas temperaturas. | Fabricação de vidro, cimento e microchips. |
Comparando o óxido de sódio (Na 2O) e o dióxido de silício (SiO 2), observamos diferenças significativas. O Na 2O é um óxido básico, reativo com água, enquanto o SiO 2 é um óxido ácido, pouco reativo. Suas aplicações também refletem essas diferenças, com o Na 2O usado em materiais que exigem reatividade e o SiO 2 em materiais que precisam de resistência e inércia.
Substâncias Ácidos: Ionização e Aplicações, Defina Substâncias Pertencentes A Função Inorgânica Básica De Dois Exemplos
Ácidos inorgânicos são compostos que, em solução aquosa, liberam íons de hidrogênio (H +), aumentando a concentração de H + e diminuindo o pH. A ionização é o processo de dissociação do ácido em íons. A nomenclatura tradicional utiliza prefixos e sufixos (como “ídrico”, “oso”, “ico”), enquanto a nomenclatura IUPAC utiliza os prefixos numéricos e o nome do ânion.
A seguir, dois exemplos de ácidos inorgânicos:
O ácido clorídrico (HCl) e o ácido sulfúrico (H 2SO 4) são exemplos importantes. O HCl é um ácido forte, totalmente ionizado em água, enquanto o H 2SO 4 também é um ácido forte, porém sua ionização ocorre em duas etapas. Ambos apresentam riscos associados ao manuseio inadequado, necessitando de cuidados especiais.
- Aplicações do Ácido Clorídrico (HCl):
- Limpeza industrial.
- Produção de cloretos.
- Ajustar o pH em processos industriais.
- Aplicações do Ácido Sulfúrico (H2SO 4):
- Produção de fertilizantes.
- Indústria petroquímica.
- Fabricação de baterias.
Comparando a força ácida, o HCl é considerado mais forte que o H 2SO 4 na primeira etapa de ionização, devido à maior facilidade de liberação do íon H +. A força de um ácido é influenciada por fatores como a polaridade da ligação H-X e a estabilidade do ânion formado após a liberação do próton.
Comparação entre Óxidos e Ácidos
Óxidos e ácidos apresentam propriedades químicas distintas. A tabela abaixo resume as principais diferenças:
| Propriedade | Óxido | Ácido | Comparação |
|---|---|---|---|
| Comportamento em solução aquosa | Podem ser básicos ou ácidos, dependendo do elemento metálico ou não metálico. | Liberam íons H+, diminuindo o pH. | Os óxidos básicos reagem com água para formar bases, enquanto os óxidos ácidos formam ácidos. |
| Reações características | Reagem com ácidos ou bases, dependendo de sua natureza. | Reagem com bases em reações de neutralização. | Os óxidos básicos reagem com ácidos, e os óxidos ácidos reagem com bases. |
| Aplicações | Diversas, desde a construção civil até a indústria eletrônica. | Diversas, desde a indústria química até a produção de alimentos. | Ambas as classes de compostos têm aplicações amplas e importantes em diversas áreas. |
A reação de neutralização entre um ácido e uma base resulta na formação de um sal e água. Por exemplo, a reação entre HCl (ácido clorídrico) e NaOH (hidróxido de sódio) produz NaCl (cloreto de sódio) e H 2O (água): <b>HCl + NaOH → NaCl + H2O</b>
A reação entre um óxido ácido e água resulta na formação de um ácido. Por exemplo, o dióxido de enxofre (SO 2) reage com água para formar ácido sulfuroso (H 2SO 3): <b>SO2 + H 2O → H 2SO 3</b> . Este processo ilustra a formação de um ácido a partir de um óxido ácido.
Outras Funções Inorgânicas e Aplicações Industriais
Além de óxidos e ácidos, outras funções inorgânicas importantes incluem bases, sais e hidretos. As bases, como o hidróxido de sódio (NaOH), são compostos que liberam íons hidroxila (OH –) em solução aquosa. Os sais são compostos iônicos formados pela reação entre um ácido e uma base. Os hidretos são compostos formados pela combinação de um elemento com hidrogênio.
A indústria utiliza amplamente substâncias inorgânicas. Por exemplo:
- Ácido sulfúrico (H2SO 4): Usado na produção de fertilizantes, baterias e na indústria petroquímica.
- Setor: Agricultura (fertilizantes).
- Setor: Energia (baterias).
- Setor: Petroquímica (refinamento de petróleo).
- Cloreto de sódio (NaCl): Usado na indústria alimentícia, na produção de cloro e soda cáustica.
- Setor: Alimentício (conservante, tempero).
- Setor: Químico (matéria-prima para cloro e soda cáustica).
- Óxido de alumínio (Al2O 3): Usado na produção de alumínio, abrasivos e cerâmicas.
- Setor: Metalurgia (produção de alumínio).
- Setor: Construção (abrasivos, materiais de construção).
Os compostos inorgânicos são essenciais para a sociedade moderna, presentes em diversos materiais e produtos do dia a dia, desde a construção civil até a eletrônica, demonstrando sua importância em várias áreas da vida humana.
Quais são as principais diferenças entre óxidos ácidos e óxidos básicos?
Óxidos ácidos reagem com água formando ácidos e com bases formando sal e água. Já os óxidos básicos reagem com água formando bases e com ácidos formando sal e água.
Como se identifica um ácido forte de um ácido fraco?
Ácidos fortes se ionizam completamente em solução aquosa, enquanto ácidos fracos se ionizam parcialmente. A constante de dissociação ácida (Ka) indica a força do ácido: valores maiores de Ka indicam ácidos mais fortes.
Cite exemplos de aplicações de óxidos na indústria.
Óxido de cálcio (CaO) na construção civil, óxido de ferro (Fe2O3) na produção de aço e dióxido de silício (SiO2) na fabricação de vidro.

